深圳先进院在人类肠道宏基因组的古菌病毒研究中获进展
2022年12月30日,中国科学院深圳先进技术研究院合成生物学研究所马迎飞团队在《自然-通讯》(Nature Communications)上,发表了题为Metagenomic analysis reveals unexplored diversity of archaeal virome in the human gut的研究论文。该工作首次对人类肠道宏基因组的古菌病毒进行深入挖掘与全面分析,揭示了人类肠道中古菌病毒组的多样性,推动了人类肠道古菌病毒组的研究进展。
人类微生物组的组成和功能与宿主的健康相关。除细菌外,肠道微生物群中的非细菌成员(古菌、真菌和病毒)也在微生物群落的动态演替以及人类的生理、免疫、疾病等方面发挥重要作用。古菌是人体的共生微生物之一,曾在肠道,口腔和皮肤等部位被检测到,且与人类疾病相关。与细菌相比,古菌在人体内的丰度相对较低,且多不可培养,因而与人类相关的古菌常被忽视。病毒控制微生物群落的组成和代谢,侵染古菌的病毒在基因组序列和病毒粒子结构方面具有较高的多样性。迄今为止,仅少数研究报道人类肠道内存在古菌病毒,而与人类相关的古菌病毒仍然神秘。随着下一代测序技术的发展以及海量数据的产生,基于宏基因组学的方法有助于科学家对人类的古菌组和古菌病毒组开展研究。本工作以人类肠道宏基因组数据为研究对象,利用生物信息学的方法,深度挖掘古菌病毒,探究它们的多样性与潜在功能。
研究表明,约90%古菌基因组包含CRISPR结构,因而CRISPR spacer-protospacer的匹配分析适用于古菌病毒序列的识别。为了全面搜索人类肠道中的古菌病毒,研究构建了人类肠道相关古菌spacer序列数据库(HGASDB,Human Gut Associated Archaeal Spacer Database),并基于HGASDB和古菌病毒的特征基因构建了一套肠道古菌病毒的鉴定方法,在收集的2271个肠道宏基因组样品中以及6个公开的病毒数据库中共鉴定出1279种古菌病毒,构成人类肠道古菌病毒组数据库(HGAVD)(图1a)。进一步,该团队对鉴定出的病毒代表序列进行质量评估,多数(67%)病毒contigs的质量无法得到评估。同时,该研究基于对病毒序列的网络分析以及病毒蛋白序列的注释信息,对HGAVD中的病毒序列进行分类学分析,其中大部分序列(68.4%)无法被分类到任何已知的病毒类别,这表明人类肠道中存在大量未知的古菌病毒。此外,研究还将HGAVD中的病毒与公共的肠道病毒数据库进行比较(图1d),发现来自HGAVD的大多数病毒(n=1,097;86%)均无法与公共数据库中的病毒聚类到一起,这表明HGAVD对肠道古菌病毒组具有良好的代表作用。综上,HGAVD扩展了人类肠道中古菌病毒多样性。
为了探究肠道古菌病毒在全球人群中的分布情况,该研究对1279条古菌病毒contigs在人类肠道样品中的丰度情况进行估计。主坐标分析(PCoA)和Anosim分析的结果显示,肠道古菌病毒群落的组成在不同性别(ANOSIM,r = 0.004,p = 0.306)和不同BMI指数(ANOSIM,r = 0.006,p = 0.201)的人群中无显著差异。然而,当以国家作为界限分析时,研究观察到这些古菌病毒在各地表现出多样性(图2a)。
研究进一步调查了这些古菌病毒在所有肠道样品中的检出率,共有7种古菌病毒在人群中的检出率>10%。虽然这些病毒被归类到7个不同的病毒簇(VCs)中,但它们的宿主均为Methanobrevibacter_A smithii(M.smithii)。就地理分布而言,这些古菌病毒在非洲人群中的检出率较低,但在亚洲、欧洲和美洲人群中则具有相对较高检出率(图2b)。在人类肠道中检出率高于1%的古菌病毒有712种,病毒序列IMG|UGV-GENOME-0271153在人群中具有最高检出率(72.2%)。该序列长度为40.51 kb,被评估为中等质量的基因组,侵染M.smithii古菌。该病毒基因组编码46个基因,其中8个基因被预测为有尾病毒的功能基因(图2c)。此外,研究从人类肠道样品中鉴定出13种smacoviruses,其长度分布在2.0~2.5kbp之间。这些病毒与古菌基因组上7个不同spacer序列相匹配,其宿主为Methanomassiliicoccus intestinalis 或Methanomassiliicoccus_A intestinalis古菌。与亚洲和美洲人群相比,smacovirus在非洲和欧洲人群中具有更高检出率(图2d)。
病毒能够以多种方式影响生态系统与微生物进化,例如,部分噬菌体能够通过裂解宿主细胞改变微生物的群落结构和生态功能;一些噬菌体能够劫持其宿主的代谢机制,改变宿主细胞代谢产物浓度;噬菌体也可作为宿主之间水平基因转移的载体。因此,对于病毒宿主的预测以及病毒与宿主相互作用的研究是探究病毒的关键步骤。为此,研究通过CRISPR spacer序列建立古菌与其病毒序列间的匹配关系,推断出每种古菌病毒的可能宿主。多数(n=1217,95.2%)古菌病毒的宿主都是甲烷短杆菌(Methanobrevibacteria_A),也是古菌中的优势属(图3a)。进一步,研究统计每个古菌属对应的VC数量以衡量病毒的多样性,其中,47个VCs只侵染M. smithii古菌,17个VCs只侵染M.smithii_A古菌,但有13个VCs与这两种古菌均有关联,这反映了古菌病毒能够跨种侵染宿主的特性。为了剖析古菌的跨宿主侵染情况,研究构建了宿主与病毒关系网络(图3c)发现,约三分之一的肠道古菌病毒均具有广泛的宿主范围,并不局限于单一物种,这为人类肠道微生物群中古菌病毒介导的基因流动网络提供了全面参考。
此外,侵染M.smithii的病毒是人类肠道古菌病毒的主要分支之一,为了进一步探索有尾古菌病毒的多样性,该团队以末端酶大亚基(Terl,Large Subunit Terminase)作为标记构建M.smithii古菌病毒的系统发育树,以此来估计这些病毒的多样性(图3d)。以上基于Terl蛋白的系统发育分析扩展了M.smithii古菌病毒的多样性,并定义了新的谱系。
虽然人类肠道中古菌的功能蛋白已被广泛研究,但对肠道内古菌病毒蛋白的认知却有限。为此,该研究从1279条古菌病毒代表序列上共预测出97,208个编码蛋白的基因,分别仅有10.8%和17.4%的基因能够与pVOG数据库及PHROG数据库中的基因相匹配,表明目前关于人类肠道古菌病毒的潜在功能知之甚少(图4a)。
在所有鉴定出的肠道古菌病毒中,M.smithii古菌病毒的蛋白功能最为多样,包含1034种不同功能的蛋白(只考虑被指定生物功能的蛋白),其中包括一些病毒特有的功能蛋白,例如与结构、包装、裂解、DNA结合/调控和复制相关的蛋白,但其他一些古菌病毒则缺乏这些病毒特有的功能蛋白(图4b)。此外,该团队还对36条完整古菌病毒代表序列的基因组进行研究(图4c),其中23条序列携带PeiW(pseudomurein endoisopeptidase)基因,揭示了该基因对于病毒侵染产甲烷古菌的重要性。此外,对33种有尾病毒基因组的分析结果表明,与人类肠道中的细菌病毒类似,温和古菌病毒在人类肠道古菌病毒中占据主体地位。
本研究对人类肠道中的古菌病毒进行了全面的宏基因组数据挖掘,为阐释人体肠道内古菌病毒的多样性和蛋白功能提供了新见解,以供科学家更好地探索人类肠道生态系统。研究工作得到中科院战略性先导科技专项(B类)、中科院定量工程生物学重点实验室、广东省合成基因组学重点实验室和深圳合成生物学创新研究院的支持。
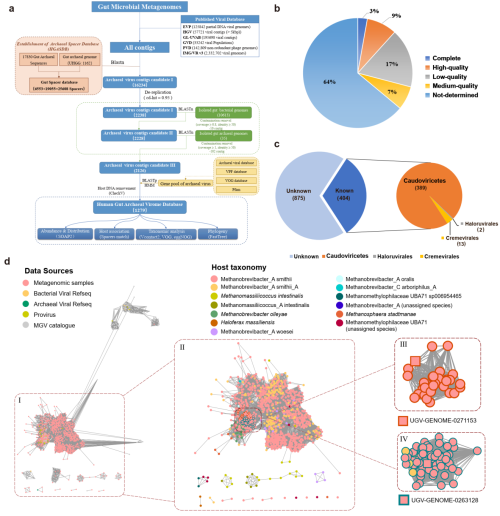
图1.肠道古菌病毒的鉴定
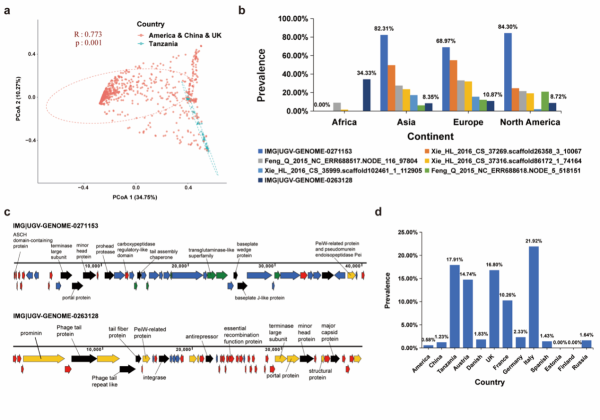
图2.肠道古菌病毒的全球分布
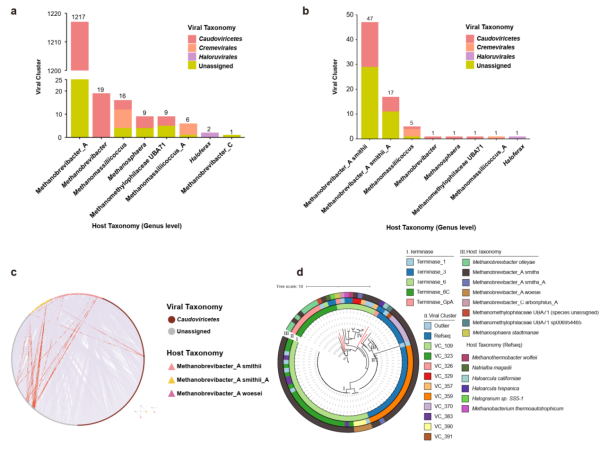
图3.古菌病毒的宿主及宿主范围
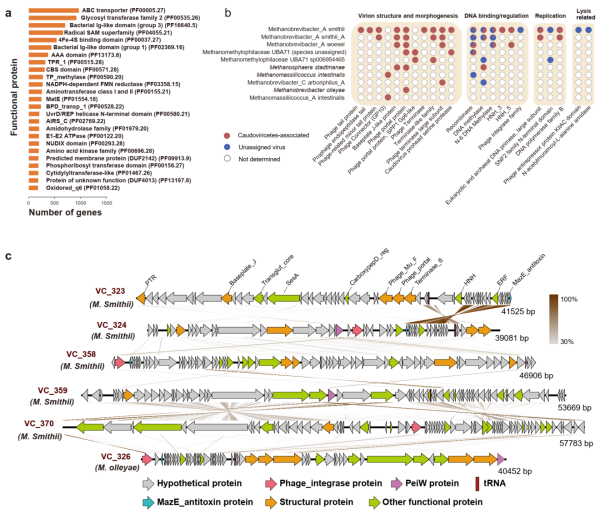
图4.肠道古菌病毒的蛋白功能
消息来源:中科院官网


