上海药物所等开发纳米探针用于脑胶质瘤的成像与治疗
脑胶质瘤作为一种高浸润性、高转移性的肿瘤,因其预后差、死亡率高、复发率高等挑战,被认为是最具侵袭性的恶性脑肿瘤之一。虽然,目前临床上已采用手术切除、放疗、化疗等多种方法来治疗脑胶质瘤,但其预后仍较差,中位总生存期仅为14-17个月。由于血脑屏障(BBB)的限制,目前发展的大部分抗肿瘤药物难以穿越BBB到达肿瘤部位,对脑胶质瘤的治疗效果不佳;此外,由于这些药物缺乏肿瘤特异性,易导致严重的毒副作用和耐药性。提高抗肿瘤药物在脑胶质瘤中的递送和疗效,实现原位脑胶质瘤的按需高效治疗仍极具挑战性。
近日,中国科学院上海药物研究所研究员柳红和南京大学教授叶德举合作,在脑胶质瘤靶向激活的有机共组装纳米诊疗探针用于原位脑胶质瘤的近红外荧光-磁共振双模态成像和化疗-光动力联合治疗的研究方面取得进展。相关成果以Controlling Disassembly of Paramagnetic Prodrug and Photosensitizer Nanoassemblies for On-Demand Orthotopic Glioma Theranostics为题于近日发表在ACS Nano上。
研究团队基于分子共组装和可控解组装策略,分别合成了αvβ3整合素靶向、谷胱甘肽响应的顺磁性近红外光敏探针(PPa-RGD)和喜树碱前药(CPT-RGD);通过优化这两个分子的共组装比例,制备了兼具生理稳定性和协同治疗的共组装纳米诊疗探针(Co-NP-RGD)(图1)。通过静脉给药后,Co-NP-RGD相比小分子药物能有效延长血液循环时间,并借助表面存在的大量cRGD靶向基团,穿越BBB,靶向递送到原位脑胶质瘤细胞(U87MG和U251)中,一方面产生增强的核磁共振成像造影信号用于定位处于脑部的原位脑胶质瘤;另一方面,在脑胶质瘤细胞内高浓度谷胱甘肽作用下,发生快速解组装,同时释放出喜树碱原药(CPT)和近红外光敏剂(PPa),从而恢复光动力治疗功能,产生增强的近红外荧光信号用于监测药物的释放和蓄积。此外,释放的小分子卟啉光敏剂进一步与肿瘤细胞内的白蛋白结合,能延长光敏剂分子在肿瘤细胞内蓄积,而同时释放的喜树碱可以抑制乏氧诱导因子HIF-1α,进而改善脑胶质瘤组织中的乏氧环境,增强对深层原位脑胶质瘤的光动力治疗疗效。在双模态成像信号的指导下,用低剂量的690 nm激光(0.2 W/cm2)照射小鼠的原位脑胶质瘤,产生化疗-光动力治疗协同治疗,能有效延缓了原位脑胶质瘤的生长,并延长小鼠的生存期,实现对原位脑胶质瘤的高效协同治疗(图2)。该研究设计的分子共组装和可控解组装策略,可以进一步应用于构建其他肿瘤靶向和激活的纳米药物以产生癌症的联合治疗效果,促进癌症的诊疗。
相关研究工作得到国家重点研发计划、国家自然科学基金、江苏省自然科学基金、南京大学卓越计划、中国博士后科学基金等项目的资助。
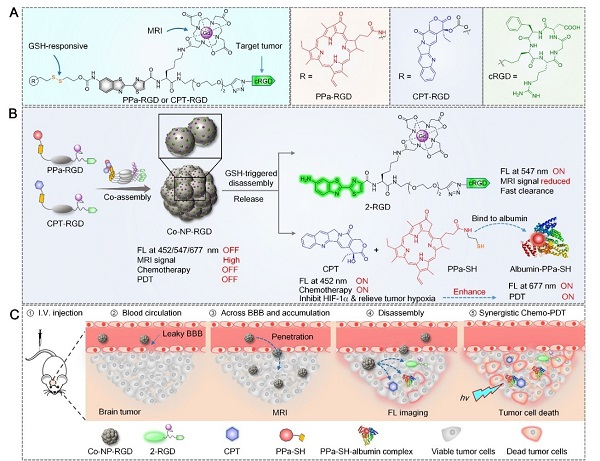
图1 共组装纳米诊疗探针的结构及作用机理图
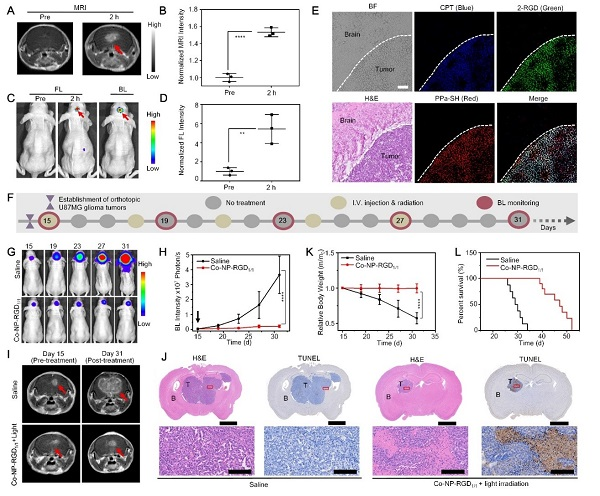
图2 小鼠体内原位脑胶质瘤的近红外荧光-核磁共振双模态成像和化疗-光动力联合治疗研究
消息来源:中科院官网


