武汉病毒所揭示病毒RdRP核苷酸添加循环新机制
发布时间:2023-01-08 09:42:58 浏览:175次
RNA病毒包括多种致病病原,对人类健康构成威胁。RNA病毒的基因组复制和转录过程需要自身编码的依赖RNA的RNA聚合酶(RNA-dependent RNA polymerase,RdRP)来主导完成。该过程经历引发(initiation)、延伸(elongation)和终止(termination)阶段,由数以千计的核苷酸添加循环(nucleotide addition cycle,NAC)组成。该循环的机制不仅是了解RNA病毒本质特征的重要内容,而且是发展针对RdRP的抗病毒策略的重要依据。现有关于病毒RdRP的研究表明,每个NAC经历四个步骤:反应底物NTP进入RdRP活性中心;RdRP活性中心关闭(active site closure);核苷酸转移(nucleotidyl transfer)反应发生(产物RNA的3’-末端添加一个核苷酸);RdRP向下一位模板核苷酸转位(translocation)从而开启下一轮循环。过去十余年间,结构生物学与酶学研究已基本完整勾勒出该NAC的机制,但始终未能准确获得催化反应(步骤3)即将发生时的RdRP结构信息,因此对于哪些氨基酸残基在催化反应中发挥关键作用存在争议。
中国科学院武汉病毒研究所研究员龚鹏团队长期从事病毒RdRP催化机制研究。近期,该团队通过在肠道病毒71型(enterovirus 71,EV71)RdRP-RNA复合物晶体浸泡实验中的多方尝试,解析了高度接近催化反应发生状态的RdRP晶体结构(图A,PDB编号:7W9S,分辨率2.5埃),发现位于RdRP基序D附近的一个赖氨酸残基K360与结构中底物CTP的g-磷酸存在近距离相互作用(3.3埃)。在与EV71同为肠道病毒的脊髓灰质炎病毒的前期研究中,等同的K359残基被认为直接参与催化反应和其中的质子转移过程,而上述晶体结构中观测到的近距离相互作用进一步提示了这种可能性。据此,该团队选取了EV71 RdRP的K360残基和另一个与CTP的磷酸基团存在相互作用的基序F精氨酸残基R174为突变位点设计了系列突变体,利用酶学方法对野生型RdRP和突变体的单步延伸速率常数和CTP米氏常数(图B)、RdRP延伸状态(elongation)和延伸前状态(pre-elongation)下催化的pH依赖性等多种参数和性质进行了表征。结果表明,K360位点的突变降低了催化效率,且在延伸和延伸前状态下都能影响RdRP的pH依赖特性,而R174位点的突变所造成的影响与K360类似且能额外降低底物CTP的亲和力。这些数据表明K360和R174均直接参与催化反应,但这两个残基是否直接参与质子转移有待进一步取证。上述成果是该团队继解析RdRP活性中心部分关闭结构(对应NAC步骤2)和揭示不对称转位现象(对应NAC步骤4)(PNAS 2016;Nature Communications 2020)等NAC系列工作后的又一成果(对应NAC步骤3),阐明了该循环的全过程机制(图C、动图)。
相关研究成果在线发表在《核酸研究》(Nucleic Acids Research)上。研究工作得到国家重点研发计划、国家自然科学基金、湖北省江夏实验室生物安全科技重大项目等的支持。
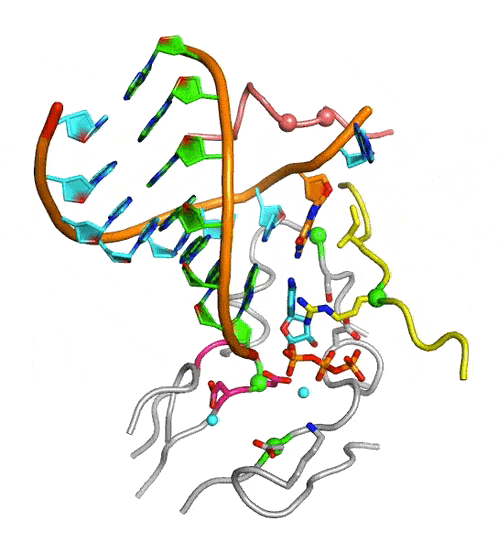
病毒RdRP完整NAC动图
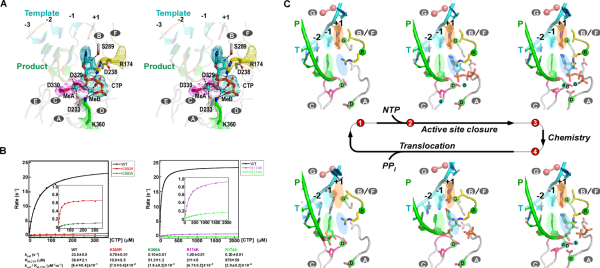
病毒RdRP核苷酸添加循环新机制。A、接近催化反应发生状态的EV71 RdRP晶体结构立体对像图;B、K360和R174位点的突变大幅降低RdRP催化效率;C、病毒RdRP核苷酸添加循环(NAC)的完整结构基础,图中参考状态1-4之间的转换过程1-2、2-3、3-4和4-1分别对应NAC步骤1、2、3和4。A和C中的RdRP基序用白色大写字母标注。
消息来源:中科院官网


