生物物理所等研发出修补线粒体损伤的小分子融合激动剂
1月12日,中国科学院生物物理研究所胡俊杰团队与南开大学陈佺团队、中科院昆明植物研究所郝小江团队合作,在Nature Chemical Biology上,发表了题为Small molecule agonist of mitochondrial fusion repairs mitochondrial dysfunction的研究论文。该研究报道了一种能够特异性激活MFN1并修补多类线粒体损伤的小分子化合物S89。
线粒体是调控细胞能量稳态和命运决定的中心。线粒体通过不断融合和分裂以维持正常功能,而分裂与融合失衡导致的线粒体过度碎片化是人类诸多疾病与衰老的重要标志之一。介导线粒体融合和分裂的分子机器均为发动蛋白(dynamin)超家族成员,其中线粒体外膜融合由线粒体融合素(MFN1和MFN2)执行。MFN2的突变导致腓骨肌萎缩症(CMT2A)等多种遗传性神经退行性疾病。因此,研发可促进线粒体融合的小分子化合物将有助于线粒体相关疾病的治疗,是生命科学和生物医学研究备受关注的前沿方向。
经过筛选,科研团队发现绣线菊提取天然产物的一种衍生物S89具有促进线粒体融合的功效。同时,该反应只在表达内源MFN1的细胞中有效。研究利用纯化MFN的体外实验表明,S89直接结合于MFN1第二个螺旋束(HB2)内的一个较松散区域。该区域在自然状态下与GTP酶相结合,可将分子锁定在无法激活的自抑制状态,而S89和HB2的结合竞争性解除该自抑制。同样,HB2松散区域的特定位点突变或GTP的结合也可解开MFN1的自抑制。总体来说,S89的处理可以将全长MFN1的酶活提升2倍左右,也可有效促进纯化MFN1在体外的融合活性。值得注意的是,同源蛋白MFN2由于自抑制效应较强,S89对其无效。
进一步,该团队利用多种细胞模型(MELAS综合症患者细胞、CMT2A患者细胞、氧化应激诱导剂百草枯及铁死亡诱导剂RLS3处理的细胞)验证了S89的生物学效应,发现了S89可以通过延伸线粒体、减少线粒体去极化、缓解线粒体氧化应激、增加线粒体ATP产量等修补线粒体功能损伤。此外,研究还发现,S89在再灌注时的注射可以减轻小鼠缺血再灌注对心肌产生的损伤。
这一针对S89机制的研究揭开了线粒体外膜融合调控的神秘面纱。S89的功效具有可逆和可控等特点,为具有多个同源基因的相关遗传病治疗提供了全新的干预思路,即对于存在MFN2突变的缺陷可以通过进一步激活内源的健康MFN1来扭转。由于线粒体碎片化在多种病理病变中普遍存在,因而对线粒体融合能力的可控提升将颇具应用前景。
研究工作得到国家自然科学基金、国家重点研发计划、中科院战略性先导科技专项(B类)、中科院稳定支持基础研究领域青年团队计划等的支持。
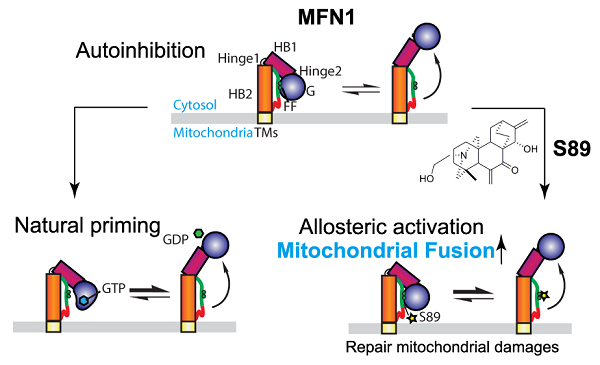
S89的作用机制
消息来源:中科院官网


