脑智卓越中心等揭示BMAL1敲除对食蟹猴肠道菌群节律性波动影响的机制
昼夜节律紊乱可引发心血管、消化道、神经退行性和肿瘤等疾病。肠道微生物与宿主密切互作,其昼夜节律稳态的维持受宿主调控并在宿主营养代谢、发育、免疫和疾病发生等方面发挥重要作用。因此,揭示肠道微生物与宿主的互作机制对于疾病发病机制的解析和疾病治疗具有重要意义。目前,针对灵长类动物肠道微生物与宿主在昼夜节律层面的互作机制鲜有报道,这限制了节律紊乱相关疾病的治疗性研究。相对于节律紊乱的小鼠模型,BMAL1敲除食蟹猴可选择表现出睡眠紊乱、抑郁和精神分裂等病征,这为肠道微生物与宿主节律性互作机制的解析以及抑郁症和精神分裂症等疾病的治疗提供了全新的动物模型。
2月28日,Cell Reports在线发表了题为Disturbed rhythmicity of intestinal hydrogen peroxide alters gut microbial oscillations in BMAL1-deficient monkeys的研究论文。该工作由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)非人灵长类研究平台孙强研究团队与扬州大学兽医学院/比较医学研究院杨云鹏课题组共同完成。该研究利用脑智卓越中心前期构建得到的BMAL1敲除猴及其克隆子代【Natl Sci Rev. 2019, 6(1):87-100;Natl Sci Rev. 2019, 6(1):101-108】解析了宿主如何通过调控肠道H2O2含量的节律性波动引发肠道微生物和代谢产物节律性变化的机制。
与Bmal1敲除小鼠肠道微生物丧失节律性波动的结果不同,BMAL1敲除猴肠道普雷沃氏菌属(Prevotella)和拟普雷沃氏菌属(Alloprevotella)微生物在夜间的富集会使其肠道微生物呈现异常的节律性波动(图1A、B),这凸显了利用非人灵长类动物开展肠道微生物与宿主节律性互作机制解析的重要性。进一步分析发现,BMAL1敲除猴肠道和血浆抗坏血酸和γ-氨基丁酸(GABA)的含量在夜间降低并呈现异常节律性波动(图1C-F),且二者与普雷沃氏菌属和拟普雷沃氏菌属微生物丰度呈负相关(图1G、H)。普雷沃氏菌属微生物P. copri可以代谢抗坏血酸和GABA;拟普雷沃氏菌属微生物A. rava只代谢GABA(图1I)。
通过对食蟹猴昼夜节律系统调控其肠道微生物发生节律性改变的机制进行解析,研究发现BMAL1可以直接结合肠道H2O2合成关键基因NOX1启动子区的BMAL1识别基序来激活其表达,使得肠道H2O2的含量发生节律性变化。H2O2外源添加实验结果显示,H2O2可降低食蟹猴肠道中普雷沃氏菌属和拟普雷沃氏菌属微生物的丰度。因此,BMAL1敲除猴中BMAL1的缺失使得其肠道H2O2含量无节律性波动且在夜间明显低于野生猴,使得受H2O2抑制的普雷沃氏菌属和拟普雷沃氏菌属微生物在夜间富集进而呈现异常的节律性波动。
该研究发现生物节律核心调控蛋白BMAL1在食蟹猴肠道可直接结合H2O2合成基因NOX1启动子区的BMAL1识别基序来激活其表达,使肠腔中H2O2含量呈现节律性波动,最终引发肠道微生物丰度和代谢物含量的节律性改变(图2)。上述调控机制在食蟹猴和人中较为保守,由于在小鼠NOX1基因启动子区未鉴定得到保守的BMAL1识别基序,因此该调控机制在啮齿类动物中的适用性有待进一步研究。
研究工作得到国家自然科学基金委员会、中科院、上海市科学技术委员会、临港实验室、江苏省的支持。
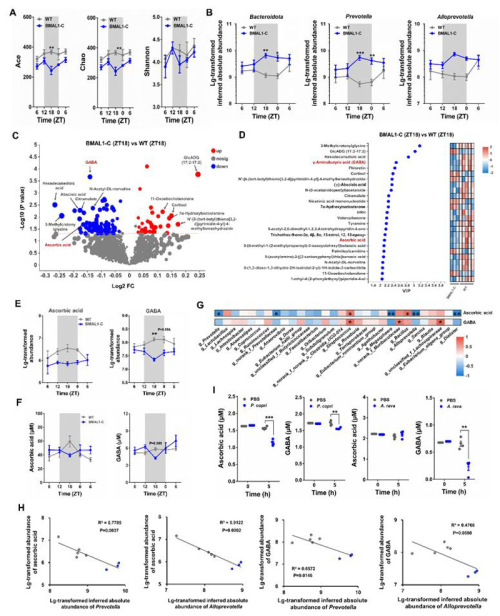
图1.BMAL1敲除猴异常肠道微生物和代谢物的发掘以及二者的关联分析
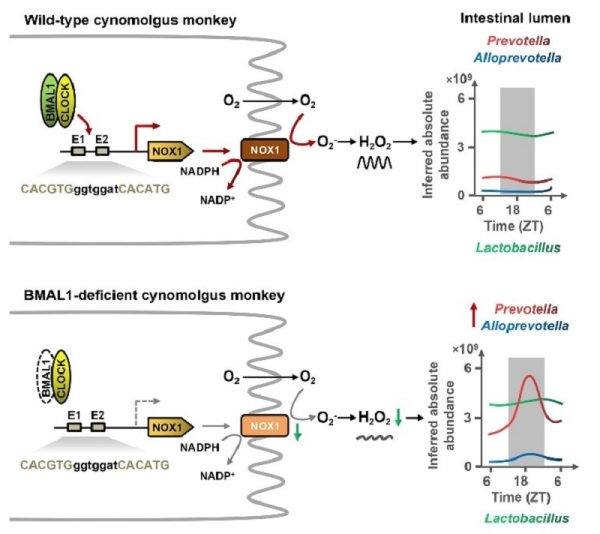
图2.BMAL1调控肠道H2O2合成进而引发肠道微生物节律性波动的机制
消息来源:中科院官网


